La famosa poesia di Samuel Coleridge ‘La ballata dell’antico marinaio‘ citato: ‘Acqua, Acqua, dovunque, né alcuna goccia da bere!’ Attraverso queste famose battute, Coleridge dichiarò di non avere acqua da consumare nonostante fosse circondato da un oceano. Ha anche detto di aver ucciso un albatro (che, secondo la tradizione locale, porta sfortuna a tutti sulla nave). Naturalmente, attraverso le sue famose battute, riafferma anche il luogo comune secondo cui il 75% della superficie terrestre è ricoperta d’acqua. Inoltre, sappiamo anche che il 60% del corpo umano è costituito da acqua. Pertanto, l’acqua (una molecola semplice) si rivela cruciale in tutti i processi.
Per far sì che gli studenti imparino di più su questo fenomeno noto (in dettaglio), gli insegnanti di chimica universitari assegnano compiti a casa sulle proprietà chimiche dell’H2O, la sua struttura, il significato ambientale, ecc. per determinare la loro profondità di comprensione. Tuttavia, gli studenti, che non conoscono le proprietà chimiche, la struttura e il significato generale, spesso hanno difficoltà a compilare documenti unici e ben studiati entro scadenze ravvicinate. Fortunatamente, diversi importanti siti web di tutoraggio per incarichi (come TopAiutante per i compiti) offrono un aiuto per i compiti di Chimica a 360 gradi su argomenti sia di base che avanzati.
Il loro tutoraggio personalizzato consente agli studenti di aumentare la conoscenza della materia/concetto, migliorare le capacità di scrittura accademica e preparare documenti meritevoli di essere presentati per ottenere voti eccellenti. Puoi provarlo se incontri difficoltà simili nel comprendere argomenti specifici di chimica inclusi nel loro curriculum.
Tuttavia, di seguito, spieghiamo lucidamente tutta la copertura del titolo per aiutarti a iniziare con i compiti.
Le proprietà chimiche dell’acqua
Essendo una sostanza chimica, (H2O) reagisce con molte sostanze per formare vari composti chimici.
Reazione Redox: Essendo una meravigliosa fonte di idrogeno (avendo 2 atomi di idrogeno che si legano covalentemente con un atomo di ossigeno), gli elementi elettropositivi riducono le molecole di idrogeno.
Durante la fotosintesi, l’H2O viene ridotto e ossidato in O2, risultando così vitale per le reazioni redox. (Visualizza esempio)
![]()
Atmosferico per natura: Molti potrebbero sapere che l’H2O può fungere da base e da acido. Ciò indica che, per sua natura, è atmosferico. (Visualizza esempio)
Comportamento acido:
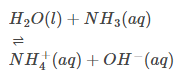
Comportamento di base:
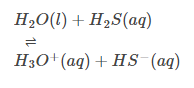 Reazione di idrolisi: Presenta inoltre una forte tendenza idratante dovuta soprattutto alla sua costante dielettrica e può sciogliere numerosi composti iconici. Alcuni composti ionici e covalenti possono essere idrolizzati.
Reazione di idrolisi: Presenta inoltre una forte tendenza idratante dovuta soprattutto alla sua costante dielettrica e può sciogliere numerosi composti iconici. Alcuni composti ionici e covalenti possono essere idrolizzati.
Sicuro assistenza per i compiti universitari da TopHomeworkHelper.com e ottieni l’accesso gratuito a numerose soluzioni di risposta/note di scrittura di chimica.
Maggiori informazioni sulle proprietà dell’H2O
- Massa molare – 8,01528(33) g/mol
- Densità solida – 0,9167 g/ml a 0 °C
- Densità del liquido – 0,961893 g/mL a 95 °C, 0,9970474 g/mL a 25 °C, 0,9998396 g/mL a 0 °C
- Punto di fusione – 0 gradi C
- Punto di ebollizione – 100 gradi C
- Acidità – 13.995
- Pressione di vapore – 0,032176 atm/3,1690 kilopascal
- Viscosità – 0,890 cP
- Conduttività termica –0,6065 W/m·K
- Indice di rifrazione – 1.3330 (nD)
- Basicità – 13.995 (pKb)
La chimica della struttura dell’acqua
La struttura chimica dell’acqua è composta da 2 diversi atomi di idrogeno che si legano con un singolo atomo di ossigeno. A causa della maggiore elettronegatività degli atomi di ossigeno, ha legami covalenti polari. L’atomo di ossigeno attira maggiormente gli elettroni condivisi dei legami covalenti rispetto agli atomi di idrogeno. Quindi, gli atomi di ossigeno vengono caricati negativamente (parzialmente) mentre gli atomi di idrogeno ricevono una carica parzialmente positiva. Gli atomi adottano quindi una struttura piegata a causa di 2 coppie di elettroni solitari sull’atomo di ossigeno. La forma piegata della molecola d’acqua si verifica a causa dei legami polari O – H che non si annullano a vicenda e perché l’intera molecola è polare.
Inoltre, i legami polari si attraggono tra loro attraverso le forze dipolo-dipolo (l’estremità positiva di una molecola viene attratta dall’estremità negativa della molecola vicina). Nell’acqua, i legami polari O-H hanno una bassa densità elettronica vicino agli atomi di idrogeno, con ciascun atomo di H2 che viene attratto dagli elettroni solitari di un atomo di O adiacente. Si chiamano legami idrogeno e sono più forti di qualsiasi normale forza dipolo-dipolo.
Significato ambientale
Con la popolazione mondiale in forte espansione ogni anno, crescono anche l’importanza ambientale e la domanda di acqua utilizzabile.
L’acqua è importante anche per nutrire, crescere e nutrire varie piante e animali (anche il movimento e l’allevamento dei pesci). Gli eventi di irrigazione di routine per le piante da fiore forniscono anche cibo e riparo a insetti, rettili, rane e mammiferi. Anche gli uccelli dei boschi rispondono bene alle zone umide sane. Possono facilmente nutrirsi e spostarsi per impollinare le piante e controllare insetti e parassiti.
L’opinione pubblica deve riconoscere con maggiore rilevanza il valore dell’acqua. L’acqua pulita è fondamentale per l’agricoltura, l’allevamento, i servizi igienico-sanitari e per il sostegno dell’ecosistema circostante. L’acqua aiuta a ripristinare e mantenere il flusso naturale nei fiumi, nelle zone umide, nei ruscelli, ecc. e aiuta a sostenere gli habitat delle pianure alluvionali.
Pertanto, è importante che il governo mondiale e gli altri organismi ufficiali responsabili sostengano un sistema idrico sano, rinnovabile e resiliente a beneficio di tutti.
Source: La chimica dell’acqua: proprietà, struttura e significato ambientale